众所周知,NGS相比传统的检测技术,如QPCR和Sanger测序等,有着明显的通量优势,可在一次检测中对上百万甚至数十亿个DNA分子进行大规模重测序,从而给出更为全面的疾病基因谱,使精准诊疗成为可能,也有助于发现一些未知的疾病相关基因变异。
随着其技术的日趋成熟和成本降低,近年来,NGS已被大规模推向了临床应用,尤其是在肿瘤临床实践中,被用来进行肿瘤驱动基因测序、靶向用药指导、肿瘤分子分型和精准诊疗等,还有更多的早筛和复发监测技术正在研发中。
不过NGS也因其技术较为复杂,影响因素较多,检测内容不一,数据分析和解读有难度,国内外都比较缺乏相关标准等原因,进一步规范化NGS的临床应用成为了挑战。在这个背景下,2018年7月10日,由中华医学会主办的《中华医学杂志》在线发表了题为《二代测序技术在肿瘤精准医学诊断中的应用专家共识》(以下简称《共识》)的最新文章,系统地阐述了NGS技术质量需求、临床肿瘤相关NGS检测内容、样本处理、测序流程、数据管理、信息学分析、结果报告解释和咨询等方面的内容。
在样本的采集和处理方面,《共识》指出适合临床NGS分析的样品类型包括新鲜组织,甲醛固定-石蜡包埋(FFPE)组织,肿瘤细胞学标本及血浆(游离DNA/RNA)等,但不管什么样本类型,都应对抽提后和文库构建后的核酸样本进行质控(声明11),关键点如下:
- 组织和血浆游离核酸的检测前质量控制分析,包括浓度和纯度分析
- 组织DNA应进行核酸完整性分析,以判断DNA质量
- 游离DNA应进行片段长度分布分析,以判断是否存在血细胞基因组DNA污染
- 文库构建后,应对文库浓度与片段长度分布进行质量控制
NGS的一个主要的挑战在于:在样本制备过程中,怎样保证起始量低、质量参差的样本,有一致的建库成功率。核酸质量的高低对于NGS测序结果的影响非常大,尤其在FFPE组织样本中,核酸降解的现象非常普遍,分子完整性较差,可被测序的模板含量较低,如果未经质控的样品按照统一的常规流程去操作,极易造成文库产量过低,PCR重复率和偏好性指标升高等问题。前者会导致数据量不足,测序失败,而后者会直接造成核酸分子的多样性降低,与原始模板的偏差变大,从而导致检测灵敏度和特异性的降低,产生假阴或假阳性结果。
在血浆样品的检测中,由于cfDNA(游离DNA)或ctDNA(循环肿瘤DNA)的含量非常有限,血细胞gDNA(基因组DNA)的释放或在核酸处理过程中引入的gDNA污染,都会显著降低cfDNA或ctDNA的浓度,不仅可能产生和上述FFPE样品一样的问题,还可能因为其携带的重要疾病基因信息被无意义的基因组数据干扰,给数据分析和解读增加难度。
过去,样品质控环节比较容易被忽视,或者存在一些误区。比较典型的误区是采用分光光度法或特异性荧光定量的方法来检测核酸分子的浓度。但其实这些方法只能检测核酸分子的浓度,却无法判断核酸的降解程度,更不能评价基因组DNA的污染,故不能满足《共识》的要求。
更为适合的样品质控技术是基于QPCR的定量方法,如KAPA hgDNA定量和质控试剂盒 (通用型)产品(KK4960),针对人类基因组中的高保守区位点设计3种不同长度片段的PCR引物,分别用于检测小片段、中片段和大片段的含量,并基于他们的相对比例来评估样品的降解程度,不仅可准确定量可测序分子的浓度,更同步完成了片段大小+片段完整性的分析,一举多得。该方法同样适合评估游离核酸样品的质量和纯度,大多数cfDNA和ctDNA的片段长度都介于100-200bp之间,因此,对于纯度较高的样品,原理上不应扩增出大片段产物,但若样品中混有基因组DNA污染时,就会很容易扩增出大片段产物,根据其绝对含量,即可评估初始样品中的污染程度。值得注意的是,NGS测序反应本质上也是一种特殊的PCR反应,所以应用QPCR技术进行检测,更能准确地反映出可被测序的模板含量,而不是所有核酸模板的含量,因此比分光光度法或荧光定量方法更为准确。当然,使用QPCR之前也需事先验证PCR体系的聚合酶活性和扩增偏好等性能指标。
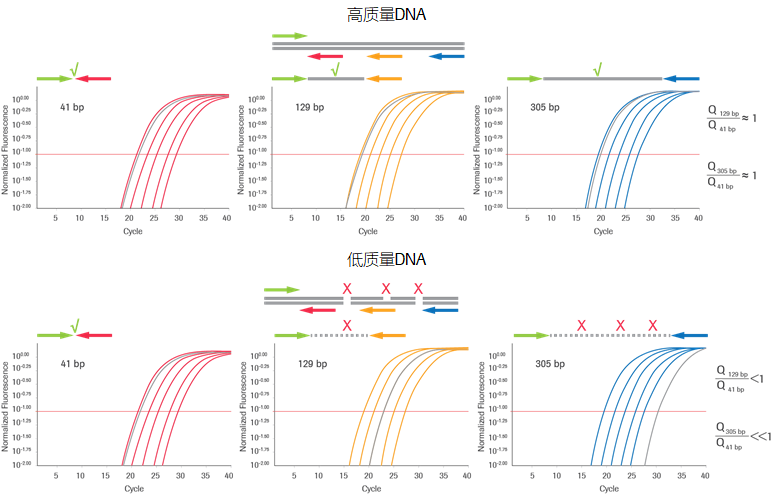
图1:人类基因组DNA定量及QC检测原理。
一组DNA标准品使用3对不同引物用于产生3组标准曲线。这3对引物的扩增目标位于人类基因组某高度保守的、单拷贝的区域,片段大小分别为41 bp,129 bp和305 bp。41 bp检测用于DNA样品的绝对定量,129 bp和/或305 bp用于片段大小和完整性评估。由于低质量的DNA样本的长片段扩增效率会大幅度降低,因此其降解程度可以通过41 bp检测的浓度对于129 bp或者305 bp检测的浓度进行标准化处理来进行推测,并用标准化质量分数(Q值,介于0-1之间)进行量化评价。
文库构建后,上机测序之前,为了最大化测序经济性,平衡不同文库混合后的通量均匀性,往往需要进行文库定量质控。而合格的文库定量亦如上述,需要采用适合的检测技术才能保障测序结果的准确性。由于接头连接反应效率、文库扩增效率和接头聚合体等诸多问题,采用分光光度法或荧光定量法同样因为其定量原理的局限性,无法排除上述干扰,导致定量高估或低估,进而造成测序数据不足或冗余,所以采用基于QPCR的文库定量方法仍是目前的“金标准”。
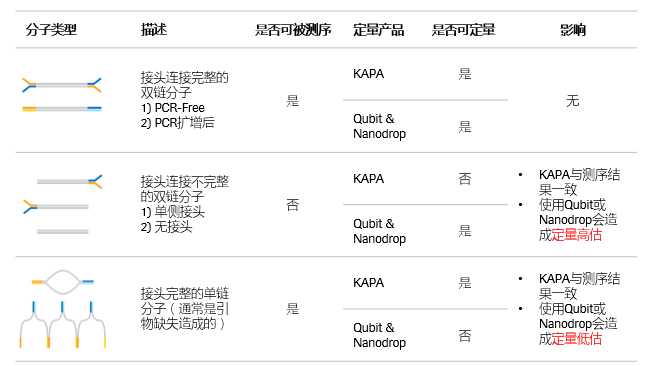
图2:基于QPCR文库定量能高准确度地定量所有可测序分子。
文库制备流程中,DNA插入片段和连接接头会产生很多连接情况,除了两端皆连接上接头的分子可以被测序外,还有一些连接情况(单端连接或未连接)不支持后续的成簇扩增,不能被测序。QPCR法仅检测接头连接正确的分子,这对于质控的有效性是特别关键的。分光光度法、荧光法和电泳法都只能检测所有的双链分子,且无法评估接头的连接情况。文库扩增后,有时过度的扩增会导致引物消耗殆尽,但变性和退火仍在进行,这些过程会产生不完全退火的部分双链、部分单链的DNA异构体。此时,采用dsDNA结合染料的电泳法和荧光法仅能检测完整的双链DNA片段,导致对过度扩增文库定量的低估。
综上所述,好的样品质控管理是产生符合临床要求的高质量测序数据的大前提。《共识》不仅首次明确了质控流程对于规范化NGS样品制备的重要性,还就进行质控和评价的方法给出了具体指导意见,这一进步实在意义重大。